Los tensoactivos o tensioactivos (también llamados surfactantes) son sustancias que influyen por medio de la tensión superficial en la superficie de contacto entre las fases agua-aire, agua-grasa. También se denominan como emulgentes o emulsionantes porque son sustancias que permiten conseguir o mantener una emulsión.
Entre los tensoactivos se encuentran las sustancias sintéticas que se utilizan regularmente en el lavado, entre las que se incluyen productos como detergentes para lavar la ropa, lavavajillas, productos para eliminar el polvo de superficies, gel de ducha y champús.
Hoy día también se producen tensoactivos a partir de fuentes naturales por extracción, siendo algunos ámpliamente aceptados en cosmética natural y biológica.
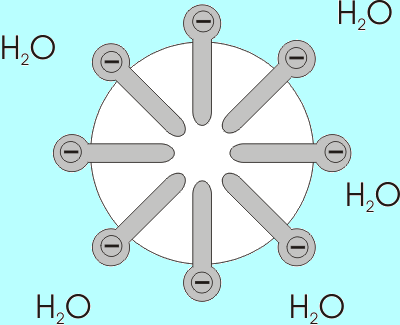
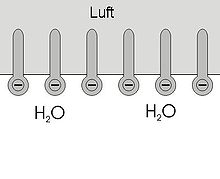
Los tensoactivos tienen carácter anfifílico, es decir, se componen de una parte hidrófoba o hidrófuga (repele el agua) y un resto hidrófilo (soluble en agua). Al contacto con el agua las moléculas individuales se orientan de tal modo que la parte hidrofóbica sobresale del nivel del agua, encarándose al aire, mientras tanto la parte hidrofílica se queda sumergida.
 Otro fenómeno ocurre cuando las moléculas anfifílicas se alinean de tal manera que las partes hidrofílicas quedan a un lado y las partes hidrófobicas al otro lado, por lo que empiezan a formar burbujas de modo que las partes hidrófobas (solubles en aceite) quedan en el centro, y los restos solubles en agua quedan en la periferia disueltos en el agua. Estas estructuras en las que los tensioactivos rodean moléculas de aceite se denominan micelas.
Otro fenómeno ocurre cuando las moléculas anfifílicas se alinean de tal manera que las partes hidrofílicas quedan a un lado y las partes hidrófobicas al otro lado, por lo que empiezan a formar burbujas de modo que las partes hidrófobas (solubles en aceite) quedan en el centro, y los restos solubles en agua quedan en la periferia disueltos en el agua. Estas estructuras en las que los tensioactivos rodean moléculas de aceite se denominan micelas.
Propiedades de los tensioactivos:
Los tensioactivos tienen propiedades emulsionantes, humectantes, detergentes y espumantes.
-
Emulsionantes y Dispersantes: tienen la capacidad de formar emulsiones. Una emulsión es una dispersión de un líquido en otro, los cuales serían inmiscibles de no ser por el agente tensioactivo. por ejemplo, emulsión de aceite en agua, o emulsión de agua en aceite.
-
Humectantes: tienen capacidad para mojar una superficie. Al disminuir la tensión superficial, se facilita la humectación de las superficies a limpiar, mojando las manchas de grasa y penetrando en los poros con mayor facilidad.
-
Detergentes: tienen la capacidad de eliminar la suciedad en los cuerpos sólidos como la piel o los tejidos. Gracias a su carácter anfifílico, sus moléculas pueden orientarse de manera que disminuyen la tensión superficial del agua y pueden rodear las moléculas de grasa.
-
Espumantes: tienen la capacidad de formar espuma para ayudar a arrastrar las impurezas y partículas de grasa descompuestas por el surfactante, y por tanto a limpiar. Pero la espuma tiene principalmente una función comercial porque el consumidor a menudo demanda productos que formen abundante espuma ya que resultan más fáciles y agradables de aplicar, y también por la falsa creencia de que un producto espumoso limpia más. No todos los tensioactivos son espumantes y, como veremos más adelante, algunos lo son más que otros.
Tipos de tensioactivos:
Las propiedades generales y el comportamiento de los agentes tensioactivos se deben al carácter dual de sus moléculas (parte hidrófila que se une al agua, y lipófila).
Existen dos categorías principaless:
1. IÓNICOS:
Tienen fuerte afinidad por el agua. Según la carga que posea la parte que presenta la actividad de superficie serán:
Aniónicos (carga negativa)
Se conocen bajo esta denominación los tensioactivos que en solución acuosa se disocian originando iones orgánicos grasos con carga negativa, a los que se debe la tensioactividad, e iones negativos sencillos que confieren solubilidad al compuesto.
Son los ingredientes principales en los productos de acción desengrasante.
Sus principales ventajas son: excelente capacidad limpiadora en usos domésticos y en aplicaciones industriales, compatibilidad con los procesos de fabricación, flexibilidad en las formulaciones, bajo coste de fabricación, rápida y elevada biodegradabilidad, y baja toxicidad acuática.
En contrapartida, cabe mencionar que son los tensioactivos más agresivos para la piel y el cabello, alteran la barrera cutánea y pueden resultar irritantes.
El jabón es el tensioactivo aniónico más antiguo.
Otros tensioactivos aniónicos son:
- Ammonium Laureth Sulfate
- Ammonium Lauryl Sulfate
- Ammonium Xylensulfonate
- Disodium Cocoyl Glutamate
- Sodium C14-16 Olefin Sulfonate
- Sodium Cetearyl Sulfate
- Sodium Coco-Sulfate
- Sodium Cocoyl Glutamate
- Sodium Cocoyl Sarcosinate
- Sodium Laureth Sulfate (SLES)
- Sodium Lauryl Sulfate (SLS)
- Sodium Lauryl Sulfoacetate
- Sodium Myreth Sulfate
- Sodium Xylensulfonate
- TEA-Dodecylbenzenesulfonate
- Ethyl PEG-15 Cocamine Sulfate
- Sodium Dioctyl Sulfosuccinate
Catiónicos (carga positiva)
Contienen carga positiva en solución acuosa. Tienen poca utilidad en limpieza porque la mayoría de las superficies tiene una carga negativa y los cationes se absorben sobre ellas en lugar de solubilizar la suciedad adherida. Sin embargo, debido a esta propiedad, tienen numerosas aplicaciones especializadas: por ejemplo las aminas y también los compuestos cuaternarios inhiben el crecimiento de organismos moleculares como las bacterias y las algas.
Estos tensioactivos son en general más costosos que los aniónicos y los no iónicos debido al número y al tipo de reacciones necesarias para su síntesis. Como consecuencia, sólo se utilizan en aplicaciones especificas: como antimicrobianos naturales o sintéticos de uso externo o como agentes de adsorción sobre sustratos biológicos inertes con carga negativa. En cosmética se suelen utilizar como acondicionadores.
Algunos tensioactivos catiónicos son:
- Behentrimonium Chloride
- Behentrimonium Methosulfate
- Benzalkonium Chloride
- Centrimonium Chloride
- Cinnamidopropyltrimonium Chloride
- Dicetyldimonium Chloride
- Dicocodimonium Chloride
- Didecyl Dimethyl Ammonium Chloride
- Hexadecyltrimethylammonium Bromide (HTAB)
- Laurtrimonium Chloride
- Quaternium-15
- Quaternium-18 Bentonite
- Quaternium-18 Hectorite
- Quaternium-22
- Stearalkonium Chloride
- Tallowtrimonium Chloride
- Tetradecyl Trimethylammonium Chloride
- Tricetyldimonium Chloride
Anfóteros (según el medio)
Tienen tanto una carga negativa como una carga positiva en la misma molécula, y tienen capacidad para formar un ion tensioactivo con cargas tanto negativas como positivas, según el pH de la solución en la que se utilicen.
Las estructuras típicas son las betaínas y los aminoácidos, que se comportan como catiónicos en solución ácida y aniónicos en solución básica.
La variedad de tensioactivos anfóteros es casi tan grande como la de tensioactivos no iónicos. Sin embargo su número se ve notablemente reducido debido a su coste o la complejidad de las reacciones implicadas. A pesar de su coste, presentan ciertas propiedades específicas que le dan cierta ventaja sobre los tensioactivos aniónicos. Estas ventajas incluyen su compatibilidad con tensioactivos catiónicos, aniónicos y no iónicos, su bajo potencial de irritación de la piel y de los ojos, o su poca sensibilidad a la dureza del agua. Es por ello que son ampliamente utilizados en formulaciones de artículos de baño y otras aplicaciones industriales.
En preparados cosméticos se utilizan para proporcionar limpieza suave. Algunos tensioactivos anfóteros producen un alto volumen de espuma, por lo que son empleados en la formulación de champús.
Algunos tensioactivos anfóteros son:
- Cocamidopropyl Betaine
- Cetyl Betaine
- Coco Betaine
- Disodium Cocoamphodiacetate
- Disodium Cocoamphodipropionate
- Lauramphopropinate
- Sodium Cocoamphoacetate
- Sodium Cocoyl Isethionate
- Sodium Lauroamphoacetate
2. NO-IÓNICOS:
Son moléculas tensioactivas que no poseen carga eléctrica en solución acuosa ya que su grupo hidrófilo no se puede disociar y por tanto, no se ven afectados por el pH de la solución. Muchos tensioactivos no iónicos podrían ser clasificados como éteres o alcoholes.
Tienen menor capacidad espumógena y viscosizante que los tensioactivos aniónicos, pero tienen la ventaja de que son excelentes agentes humectantes y apenas alteran la función barrera cutánea.
Se utilizan para la limpieza suave y estabilización de la emulsión. Son compatibles tanto con aniónicos como con catiónicos y no son afectados por los iones calcio-magnesio del agua dura.
Algunos tensioactivos no iónicos son:
- Coco Glucoside
- Decyl Glucoside
- Lauryl Glucoside
- Laureth-10
- Laureth-23
- Laureth-4
- PPG-1-Trideceth-6
- PEG-10 Sorbitan Laurate
- Polyglyeryl-4 Caprate
- Polysorbate-(20, 21, 40, 60, 61, 65, 80, 81)
- Sorbitol
- Steareth-(2, 10, 15, 20)
- C11-21-Pareth-(número entre 3 y 30. Cuanto más alto es el número, más soluble en agua y más alta es la porción hidrófila)
- C12-20 Acid PEG-8 Ester